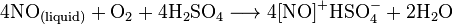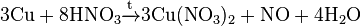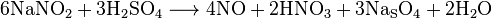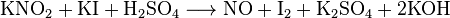Оксид азота — формула, характеристика и свойства химического вещества
Содержание:
- Литература[править | править код]
- Физико-химическая характеристика
- Сферы применения
- Физические свойства оксида азота (IV):
- Краткая характеристика оксида азота (IV):
- Характеристики
- Химические свойства
- Получение[править | править код]
- Химические свойства
- релиз
- Азот N2
- Литература[править | править код]
- Токсичность
- Оксид азота N2O5(V)
- Как получают оксиды азота
- Естественное разложение NO x
- Получение
- Страницы
- Предельно допустимая концентрация двуокиси азота
- Что такое Закись Азота
Литература[править | править код]
Оксиды
| H2O | ||||||||||||||||
| Li2OLiCoO2Li3PaO4Li5PuO6Ba2LiNpO6LiAlO2Li3NpO4Li2NpO4Li5NpO6LiNbO3 | BeO | B2O3 | С3О2C12O9COC12O12C4O6CO2 | N2ONON2O3N4O6NO2N2O4N2O5 | O | F | ||||||||||
| Na2ONaPaO3NaAlO2Na2PtO3 | MgO | AlOAl2O3NaAlO2LiAlO2AlO(OH) | SiOSiO2 | P4OP4O2P2O3P4O8P2O5 | S2OSOSO2SO3 | Cl2OClO2Cl2O6Cl2O7 | ||||||||||
| K2OK2PtO3KPaO3 | CaOCa3OSiO4CaTiO3 | Sc2O3 | TiOTi2O3TiO2TiOSO4CaTiO3BaTiO3 | VOV2O3V3O5VO2V2O5 | FeCr2O4CrOCr2O3CrO2CrO3MgCr2O4 | MnOMn3O4Mn2O3MnO(OH)Mn5O8MnO2MnO3Mn2O7 | FeCr2O4FeOFe3O4Fe2O3 | CoFe2O4CoOCo3O4CoO(OH)Co2O3CoO2 | NiONiFe2O4Ni3O4NiO(OH)Ni2O3 | Cu2OCuOCuFe2O4Cu2O3CuO2 | ZnO | Ga2OGa2O3 | GeOGeO2 | As2O3As2O4As2O5 | SeOCl2SeOBr2SeO2Se2O5SeO3 | Br2OBr2O3BrO2 |
| Rb2ORbPaO3Rb4O6 | SrO | Y2O3YOFYOCl | ZrO(OH)2ZrO2ZrOSZr2О3Сl2 | NbONb2O3NbO2Nb2O5Nb2O3(SO4)2LiNbO3 | Mo2O3Mo4O11MoO2Mo2O5MoO3 | TcO2Tc2O7 | Ru2O3RuO2Ru2O5RuO4 | RhORh2O3RhO2 | PdOPd2O3PdO2 | Ag2OAg2O2 | Cd2OCdO | In2OInOIn2O3 | SnOSnO2 | Sb2O3Sb2O4Hg2Sb2O7Sb2O5 | TeO2TeO3 | I2O4I4O9I2O5 |
| Cs2OCs2ReCl5O | BaOBaPaO3BaTiO3BaPtO3 | HfO(OH)2HfO2 | Ta2OTaOTaO2Ta2O5 | WO2Br2WO2WO2Cl2WOBr4WOF4WOCl4WO3 | Re2OReORe2O3ReO2Re2O5ReO3Re2O7 | OsOOs2O3OsO2OsO4 | Ir2O3IrO2 | PtOPt3O4Pt2O3PtO2K2PtO3Na2PtO3PtO3 | Au2OAuOAu2O3 | Hg2OHgO(Hg3O2)SO4Hg2O(CN)2Hg2Sb2O7Hg3O2Cl2Hg5O4Cl2 | Tl2OTl2O3 | Pb2OPbOPb3O4Pb2O3PbO2 | BiOBi2O3Bi2O4Bi2O5 | PoOPoO2PoO3 | At | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | |
| ↓ | ||||||||||||||||
| La2O2SLa2O3 | Ce2O3CeO2 | PrOPr2O2SPr2O3Pr6O11PrO2 | NdONd2O2SNd2O3NdHO | Pm2O3 | SmOSm2O3 | EuOEu3O4Eu2O3EuO(OH)Eu2O2S | Gd2O3 | Tb | Dy2O3 | Ho2O3Ho2O2S | Er2O3 | Tm2O3 | YbOYb2O3 | Lu2O2SLu2O3LuO(OH) | ||
| Ac2O3 | UO2UO3U3O8 | PaOPaO2Pa2O5PaOS | ThO2 | NpONpO2Np2O5Np3O8NpO3 | PuOPu2O3PuO2PuO3PuO2F2 | AmO2 | Cm2O3CmO2 | Bk2O3 | Cf2O3 | Es | Fm | Md | No | Lr |
Физико-химическая характеристика
Физические характеристики
| Молекулярная масса (усл. ед.) | 30,01 | Температура кипения (С) | -151,7 |
| Плотность пара по воздуху | 1,04 | Температура плавления (С) | -163,7 |
| Плотность (г/м3) | Температура разрушения (С) | 20 | |
| Скорость испарения (кг*с/м3) | 0,03375 | Удельная теплота парообразования (кДж/кг) | 410 |
| Давление пара (мм рт.ст.) при ну | 26000 | Удельная теплоёмкость жидкости (кДж/кг*С) | 3,55 |
| Запах | резкий сладковатый | Термостабильность |
Методы индикации
В воздухе: метод основан на предварительном окислении окиси азота до двуокиси азота с помощью перманганата калия или окислительной смеси, нанесенный на твердый сорбент и последующим определении диоксида азота по образованию азотокрасителя с реактивом Грисса-Илосвая; чувствительность 0,3 мкг в анализируемом объеме.
Сферы применения
Веселящий газ – это субстанция, которая на протяжении многих десятилетий используется в области анестезиологии. Применяют вещество при проведении операций, а также в стоматологии. Широкое распространение закись веселящего газа приобрела в гинекологии.
При соединении в оптимальных пропорциях с кислородом вещество оказывает на организм человека обезболивающий эффект, позволяет устранить нервное напряжение. Подобные свойства становятся полезными при лечении заболеваний хирургическим путем, в случае протезирования либо удаления зубов, в ходе родовой деятельности.
Первоначально, когда врачи до конца не понимали – что это веселящий газ, субстанция применялась без соединения с кислородом. Неразбавленное вещество предлагали вдыхать пациентам на протяжении нескольких минут, что нередко приводило задержкам дыхания и летальному исходу. Подобные случаи вызвали необходимость разработки специального агрегата, который создавал безопасную закись веселящего газа и кислорода. Правильное применение субстанции показало отсутствие вреда для самочувствия. Азот (веселящий газ) быстро выводился из организма и позволял человеку возвратиться к адекватному восприятию вещей.
В наши дни вещество находится в свободном доступе. Часто продавцы не отмечают, что веселящий газ – это довольно опасная субстанция, которую дозволено применять лишь в ограниченных дозах. Таким образом, сформировалось новое направление токсикомании.
Физические свойства оксида азота (IV):
| Наименование параметра: | Значение: |
| Химическая формула | NO2 |
| Синонимы и названия иностранном языке | nitrogen dioxide (англ.)
nitrogen(IV) oxide (англ.) азота двуокись (рус.) азота диоксид (рус.) диазота тетраоксид (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | красно-бурый газ или желтоватая жидкость |
| Цвет | красно-бурый, желтоватый |
| Вкус | —* |
| Запах | характерный острый запах |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | жидкость |
| Плотность (состояние вещества – жидкость, при 0 °C), кг/м3 | 1491 |
| Плотность (состояние вещества – жидкость, при 0 °C), г/см3 | 1,491 |
| Плотность (состояние вещества – газ), кг/м3 | 2,0527 |
| Плотность (состояние вещества – газ), г/л | 2,0527 |
| Температура кипения, °C | 21,1 |
| Температура плавления, °C | -11,2 |
| Молярная масса, г/моль | 46,0055 |
Примечание:
* — нет данных.
Краткая характеристика оксида азота (IV):
Оксид азота (IV) – неорганическое вещество, ядовитый газ, красно-бурого цвета, с характерным острым запахом или желтоватая жидкость.
Оксид азота (IV) содержит один атом азота и два атома кислорода.
Химическая формула оксида азота (IV) NO2.
В обычном состоянии NO2 существует в равновесии со своим димером N2O4. Склонность к его образованию объясняется наличием в молекуле NO2 неспаренного электрона.
При температуре 140 °C оксид азота (IV) состоит только из молекул NO2, но очень тёмного, почти чёрного цвета.
В точке кипения NO2 – +21,1 °C представляет собой желтоватую жидкость, содержащую около 0,1 % NO2.
При температуре ниже +21°С – это бесцветная жидкость (или желтоватая из-за примеси мономера).
При температуре ниже −12 °C белые кристаллы состоят только из молекул N2O4.
Кислотный оксид.
Оксид азота (IV) высокотоксичен. Даже в небольших концентрациях он раздражает дыхательные пути, в больших концентрациях вызывает отёк лёгких.
Характеристики
Диоксид азота представляет собой красновато-коричневый газ при температуре выше 21,2 ° C (70,2 ° F; 294,3 K) с резким, едким запахом, становится желтовато-коричневой жидкостью при температуре ниже 21,2 ° C (70,2 ° F; 294,3 K) и превращается в бесцветный четырехокись азота ( N2О4) ниже -11,2 ° C (11,8 ° F, 261,9 K).
Длина связи между атомом азота и атомом кислорода составляет 119,7 пм . Эта длина связи соответствует порядку связи от одного до двух.
В отличие от озона , O 3 , основное электронное состояние диоксида азота представляет собой дублетное состояние , поскольку азот имеет один неспаренный электрон, что снижает альфа-эффект по сравнению с нитритом и создает слабое связывающее взаимодействие с неподеленными парами кислорода. Одинокий электрон в NO2также означает, что это соединение является свободным радикалом , поэтому формула диоксида азота часто записывается как • NO2.
Красновато-коричневый цвет является следствием преимущественного поглощения света в синей области спектра (400-500 нм), хотя поглощение распространяется во всем видимом (на более коротких длинах волн) и в инфракрасном диапазоне (на более длинных волнах). Поглощение света на длинах волн короче примерно 400 нм приводит к фотолизу (с образованием NO + O, атомарного кислорода); в атмосфере добавление образовавшегося таким образом атома O к O 2 приводит к образованию озона.
Химические свойства
Представляет собой типичный кислотный оксид. Вещество легко возгоняется и крайне неустойчиво. Разложение может происходить со взрывом, часто — без видимых побудительных причин:
- 2N2O5⟶4NO2↑+O2↑{\displaystyle {\ce {2N2O5->4NO2\uparrow +O2\uparrow }}}.
Бурно реагирует с водой с образованием азотной кислоты:
- N2O5+H2O⟶2HNO3{\displaystyle {\ce {N2O5 + H2O -> 2 HNO3}}}
Взаимодействует со щелочами с образованием соответствующих нитратов:
- N2O5+2NaOH⟶2NaNO3+H2O{\displaystyle {\ce {N2O5 + 2 NaOH -> 2 NaNO3 + H2O}}}.
Является сильным окислителем:
- N2O5+Na⟶NaNO3+NO2↑{\displaystyle {\ce {N2O5 + Na -> NaNO3 + NO2 ^}}},
- N2O5+I2⟶I2O5+N2↑{\displaystyle {\ce {N2O5 + I2 -> I2O5 + N2 ^}}}.
При взаимодействии с гемиоксидом хлора при охлаждении жидким воздухом образует нитрат хлора:
- Cl2O+N2O5⟶2ClNO3{\displaystyle {\ce {Cl2O + N2O5 -> 2ClNO3}}}.
Получение[править | править код]
Рекомендуется капать 50%-ю азотную кислоту на твёрдый оксид мышьяка(III):
-
- 2HNO3(50%)+As2O3→NO2↑+ NO↑+ 2H3AsO4{\displaystyle {\mathsf {2HNO_{3}(50\%)+As_{2}O_{3}\rightarrow NO_{2}\uparrow +~NO\uparrow +~2H_{3}AsO_{4}}}}
N2O3 образуется при охлаждении до −36 °С получающейся смеси оксидов азота (II) и (IV):
-
- NO+NO2→N2O3{\displaystyle {\mathsf {NO+NO_{2}\rightarrow N_{2}O_{3}}}}
При пропускании электрического разряда через жидкий воздух N2O3 можно получить в виде порошка голубого цвета:
-
- N2+O2→2NO{\displaystyle {\mathsf {N_{2}+O_{2}\rightarrow 2NO}}}
-
- 2NO+O2→2NO2{\displaystyle {\mathsf {2NO+O_{2}\rightarrow 2NO_{2}}}}
-
- NO+NO2→N2O3{\displaystyle {\mathsf {NO+NO_{2}\rightarrow N_{2}O_{3}}}}
Также N2O3 можно получить действием 50%-ой азотной кислоты на крахмал:
-
- (C6H10O5)n+12nHNO3→6nNO↑+ 6nNO2↑+ 6nCO2↑+ 11nH2O{\displaystyle {\mathsf {(C_{6}H_{10}O_{5})_{n}+12nHNO_{3}\rightarrow 6nNO\uparrow +~6nNO_{2}\uparrow +~6nCO_{2}\uparrow +~11nH_{2}O}}}
- NO+NO2→N2O3{\displaystyle {\mathsf {NO+NO_{2}\rightarrow N_{2}O_{3}}}}
Химические свойства
Наиболее характерной свойством монооксида азота является его способность легко сочетаться при обычных условиях с кислородом воздуха с образованием диоксида азота (реакция имеет большое значение при производстве азотной кислоты):
При высокотемпературном нагреве и в присутствии катализатора BaO, газообразные NO разлагается на простые соединения. Жидкий NO с течением времени может диспропорционуваты с образованием оксидов азота (I) и азота (III):
При взаимодействии с галогенами или серной кислотой (в присутствии кислорода), NO окисляется с образованием соединений нитрозила:
Аналогично он образует нитрозильни комплексы с металлами в водных растворах солей:
Оксид азота восстанавливается до свободного азота графитом, красным фосфором, неметаллическими соединениями-восстановителями, а также некоторыми металлами:
релиз
Веселящий газ в основном образуется как побочный продукт естественных процессов, например, в процессе бактериальной нитрификации , и выбрасывается в атмосферу. Как побочный продукт техногенных процессов, закись азота выделяется не только в процессе горения, но и в результате интенсивного . Растущее использование азотных удобрений в сельском хозяйстве в первую очередь является причиной антропогенных выбросов закиси азота . По сравнению с традиционным сельским хозяйством , органическое сельское хозяйство производит примерно на 40% меньше закиси азота на гектар.
| Источники закиси азота | глобальные выбросы [10 6 т / год] |
|---|---|
| природные источники | 6,6–12,2 |
| • Океаны / озера | 2,0-4,0 |
| • естественные почвы | 4.6-8.2 |
| антропогенные источники | 1,4-6,5 |
| • Сжигание биомассы | 0,2–2,4 |
| • Использование искусственных удобрений (почва и грунтовые воды) | 1,0–3,6 |
| все источники | 8,9-18,7 |
Другими возможными источниками являются фотохимические реакции в стратосфере и тропосфере и образование закиси азота катализаторами.
Азотные удобрения при определенных условиях превращаются в закись азота. Обычно N 2 O ферментативно расщепляется в почве. Медьсодержащий фермент монооксид-редуктаза диазота играет важную роль в продолжающемся биохимическом процессе , поскольку он превращает N 2 O в N 2 (→ денитрификация ). Однако этот фермент чувствителен к кислороду и часто дает сбой в цепочке реакций . Поэтому большие количества N 2 O выбрасываются с удобренных пахотных земель. При выращивании энергетических культур, таких как рапс, выделяется большее количество закиси азота из-за увеличения количества удобрений, особенно зимой. Выбросы N 2 O от выращивания рапса соответствуют выбросам от других полей. В результате с точки зрения выбросов N 2 O климатический баланс рапса более отрицательный, чем у бензина.
Концентрация веселящего газа в атмосфере Земли с первого года ( анализ керна льда , измерения на мысе Грим (Австралия), NOAA , март 2017 г.)
Более поздние исследования показали , что меры по снижению выбросов оксидов азота от процессов горения также приводят к значительному увеличению иногда в выбросах оксидов азота ( компромиссный ). Например, электростанции со сжиганием в циркулирующем псевдоожиженном слое , которые выделяют мало оксида азота из-за процесса, имеют очень высокие выбросы оксида азота. То же самое относится к автомобилям с регулируемым трехкомпонентным каталитическим нейтрализатором , влияние которого на глобальный бюджет N 2 O (по состоянию на 2017 год) все еще остается неопределенным.
В химической промышленности синтез адипиновой кислоты ( предшественника полиамида ) — это процесс, при котором выделяется веселящий газ.
При определенных условиях закись азота может также образовываться на твердых поверхностях при нормальных условиях . Впервые это было замечено в соленом озере в Антарктике.
В отличие от этих источников, в качестве стока, является фотохимическая деградация в стратосфере с примерно 20,5 · 10 6 т / год.
- N2О+ЧАСν⟶N2+О{\ displaystyle \ mathrm {N_ {2} O + h \ nu \ longrightarrow N_ {2} + O}}
- N2О+О⟶N2+О2{\ displaystyle \ mathrm {N_ {2} O + O \ longrightarrow N_ {2} + O_ {2}}}
- N2О+О⟶2 NО{\ displaystyle \ mathrm {N_ {2} O + O \ longrightarrow 2 \ NO}}
Количества, которые также распадаются за счет поглощения почвой и водными микроорганизмами, неизвестны.
Азот N2
Простое вещество. Состоит из неполярных молекул с очень устойчивой ˚σππ-связью N≡N, этим объясняется химическая инертность элемента при обычных условиях.
Бесцветный газ без вкуса и запаха, конденсируется в бесцветную жидкость (в отличие от O2).
Главная составная часть воздуха 78,09% по объему, 75,52 по массе. Из жидкого воздуха азот выкипает раньше, чем кислород. Малорастворим в воде (15,4 мл/1 л H2O при 20 ˚C), растворимость азота меньше, чем у кислорода.
При комнатной температуре N2, реагирует с фтором и в очень малой степени – с кислородом:
N2 + 3F2 = 2NF3, N2 + O2 2NO
Обратимая реакция получения аммиака протекает при температуре 200˚C, под давлением до 350 атм и обязательно в присутствии катализатора (Fe, F2O3, FeO, в лаборатории при Pt )
N2 + 3H2 2NH3 + 92 кДж
В соответствии с принципом Ле-Шателье увеличение выхода аммиака должно происходить при повышении давления и понижении температуры. Однако скорость реакции при низких температурах очень мала, поэтому процесс ведут при 450-500 ˚C, достигая 15%-ного выхода аммиака. Непрориагировавшие N2 и H2 возвращают в реактор и тем самым увеличивают степень протекания реакции.
Азот химически пассивен по отношению к кислотам и щелочам, не поддерживает горения.
Получение в промышленности – фракционная дистилляция жидкого воздуха или удаление из воздуха кислорода химическим путем, например по реакции 2C(кокс) + O2 = 2CO при нагревании. В этих случаях получают азот, содержащий так же примеси благородных газов (главным образом аргон).
В лаборатории небольшие количества химически чистого азота можно получить по реакции конмутации при умеренном нагревании:
N-3H4N3O2(T) = N2 + 2H2O (60-70)
Применяется для синтеза аммиака. Азотной кислоты и других азотсодержащих продуктов, как инертная среда проведения химических и металлургических процессов и хранения огнеопасных веществ.
Литература[править | править код]
Оксиды
| H2O | ||||||||||||||||
| Li2OLiCoO2Li3PaO4Li5PuO6Ba2LiNpO6LiAlO2Li3NpO4Li2NpO4Li5NpO6LiNbO3 | BeO | B2O3 | С3О2C12O9COC12O12C4O6CO2 | N2ONON2O3N4O6NO2N2O4N2O5 | O | F | ||||||||||
| Na2ONaPaO3NaAlO2Na2PtO3 | MgO | AlOAl2O3NaAlO2LiAlO2AlO(OH) | SiOSiO2 | P4OP4O2P2O3P4O8P2O5 | S2OSOSO2SO3 | Cl2OClO2Cl2O6Cl2O7 | ||||||||||
| K2OK2PtO3KPaO3 | CaOCa3OSiO4CaTiO3 | Sc2O3 | TiOTi2O3TiO2TiOSO4CaTiO3BaTiO3 | VOV2O3V3O5VO2V2O5 | FeCr2O4CrOCr2O3CrO2CrO3MgCr2O4 | MnOMn3O4Mn2O3MnO(OH)Mn5O8MnO2MnO3Mn2O7 | FeCr2O4FeOFe3O4Fe2O3 | CoFe2O4CoOCo3O4CoO(OH)Co2O3CoO2 | NiONiFe2O4Ni3O4NiO(OH)Ni2O3 | Cu2OCuOCuFe2O4Cu2O3CuO2 | ZnO | Ga2OGa2O3 | GeOGeO2 | As2O3As2O4As2O5 | SeOCl2SeOBr2SeO2Se2O5SeO3 | Br2OBr2O3BrO2 |
| Rb2ORbPaO3Rb4O6 | SrO | Y2O3YOFYOCl | ZrO(OH)2ZrO2ZrOSZr2О3Сl2 | NbONb2O3NbO2Nb2O5Nb2O3(SO4)2LiNbO3 | Mo2O3Mo4O11MoO2Mo2O5MoO3 | TcO2Tc2O7 | Ru2O3RuO2Ru2O5RuO4 | RhORh2O3RhO2 | PdOPd2O3PdO2 | Ag2OAg2O2 | Cd2OCdO | In2OInOIn2O3 | SnOSnO2 | Sb2O3Sb2O4Hg2Sb2O7Sb2O5 | TeO2TeO3 | I2O4I4O9I2O5 |
| Cs2OCs2ReCl5O | BaOBaPaO3BaTiO3BaPtO3 | HfO(OH)2HfO2 | Ta2OTaOTaO2Ta2O5 | WO2Br2WO2WO2Cl2WOBr4WOF4WOCl4WO3 | Re2OReORe2O3ReO2Re2O5ReO3Re2O7 | OsOOs2O3OsO2OsO4 | Ir2O3IrO2 | PtOPt3O4Pt2O3PtO2K2PtO3Na2PtO3PtO3 | Au2OAuOAu2O3 | Hg2OHgO(Hg3O2)SO4Hg2O(CN)2Hg2Sb2O7Hg3O2Cl2Hg5O4Cl2 | Tl2OTl2O3 | Pb2OPbOPb3O4Pb2O3PbO2 | BiOBi2O3Bi2O4Bi2O5 | PoOPoO2PoO3 | At | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | |
| ↓ | ||||||||||||||||
| La2O2SLa2O3 | Ce2O3CeO2 | PrOPr2O2SPr2O3Pr6O11PrO2 | NdONd2O2SNd2O3NdHO | Pm2O3 | SmOSm2O3 | EuOEu3O4Eu2O3EuO(OH)Eu2O2S | Gd2O3 | Tb | Dy2O3 | Ho2O3Ho2O2S | Er2O3 | Tm2O3 | YbOYb2O3 | Lu2O2SLu2O3LuO(OH) | ||
| Ac2O3 | UO2UO3U3O8 | PaOPaO2Pa2O5PaOS | ThO2 | NpONpO2Np2O5Np3O8NpO3 | PuOPu2O3PuO2PuO3PuO2F2 | AmO2 | Cm2O3CmO2 | Bk2O3 | Cf2O3 | Es | Fm | Md | No | Lr |
Токсичность
Газообразный NO2диффундирует в жидкость эпителиальной выстилки (ELF) респираторного эпителия и растворяется. Там он химически реагирует с молекулами антиоксидантов и липидов в СНЧ. Влияние NO на здоровье2вызваны продуктами реакции или их метаболитами, которые представляют собой активные формы азота и активные формы кислорода, которые могут вызывать бронхоспазм , воспаление, снижение иммунного ответа и могут оказывать влияние на сердце.
Пути, указанные пунктирной линией, представляют собой те, для которых доказательства ограничены результатами экспериментальных исследований на животных, в то время как данные исследований контролируемого воздействия на человека доступны для путей, указанных сплошной линией. Пунктирными линиями обозначены предполагаемые связи с исходами обострения астмы и инфекций дыхательных путей. Ключевые события — это субклинические эффекты, конечные точки — это эффекты, которые обычно измеряются в клинике, а исходы — это последствия для здоровья на уровне организма. NO 2 = диоксид азота; ELF = жидкость эпителиальной выстилки.
Трубка для диффузии диоксида азота для контроля качества воздуха. Расположен в лондонском Сити
Острый вред из-за НЕТ2воздействие может возникнуть только в профессиональных условиях. Прямое попадание на кожу может вызвать раздражение и ожоги. Только очень высокие концентрации газообразной формы вызывают немедленное расстройство: 100–200 частей на миллион могут вызвать легкое раздражение носа и горла, 250–500 частей на миллион могут вызвать отек , приводящий к бронхиту или пневмонии , а уровни выше 1000 частей на миллион могут вызвать смерть из-за удушье из-за жидкости в легких. Во время воздействия часто нет никаких симптомов, кроме преходящего кашля, усталости или тошноты, но через несколько часов воспаление в легких вызывает отек.
При попадании на кожу или в глаза пораженный участок промывают физиологическим раствором. Для ингаляции вводится кислород, могут вводиться бронходилататоры , а если есть признаки метгемоглобинемии , состояния, которое возникает, когда соединения на основе азота влияют на гемоглобин в красных кровяных тельцах, можно вводить метиленовый синий .
Он классифицируется как чрезвычайно опасное вещество в Соединенных Штатах, как определено в разделе 302 Закона США о чрезвычайном планировании и праве на информацию (42 USC 11002), и в отношении него действуют строгие требования к отчетности со стороны предприятий, которые производят, хранят , или использовать его в значительных количествах.
Оксид азота N2O5(V)
Строение молекулы:
Связи N+-O- образуются по донорно-акцепторному механизму: атом азота отдает электрон, играя роль донора и приобретая положительный заряд, атом кислорода присоединяет электрон, выступая в роли акцептора и приобретая отрицательный заряд. Атомы азота проявляют степень окисления +5 (валентность 4).
Оксид азота N2O5(V) (азотный ангидрид, пентаоксид диазота) является кристаллическим веществом белого цвета, легко разлагающееся при нормальных условиях:2N2O5 = 4NO2+O2
Оксид азота N2O5(V) является кислотным оксидом, который при растворении в воде образует азотную кислоту:
N2O5+H2O = 2HNO3
Оксиды азота N2O3 и N2O5 практического применения не имеют.
Другие соединения азота:
- Аммиак
- Азотная кислота
Как получают оксиды азота
Закись N2O образуется при острожном нагревании аммония нитрата в сухом виде, однако такой способ может сопровождаться взрывом.
Предпочтительным методом получения оксида одновалентного является воздействие кислотой азотной в концентрированном виде на кислоту сульфаминовую. Главным условием считается нагревание.
Нитрозил, или NO, – это особый оксид азота, получение которого осуществляется при взаимодействии молекул N2 иO2. Важным условием такого процесса является сильное нагревание свыше 1000 °C.
Природный способ получения связан с грозовыми разрядами в атмосферном воздухе. Такой оксид быстро соединяется с кислородными молекулами и формируется диоксид.
Лабораторный метод синтеза NO связан с реакцией металлов и неконцентрированной кислоты азотной. Примером такой реакции может быть взаимодействие меди с HNO3.
Другой способ образования моноокиси азота — реакция хлорида железа двухвалентного с натрия нитритом и кислотой соляной. Результатом процесса являются железа трехвалентного и натрия хлориды, вода и сама окись.
В промышленных масштабах его добывают за счет окисления аммиачных молекул во время нагревания и под высоким давлением. Ускорителем процесса является платина или хрома трехвалентного оксид.
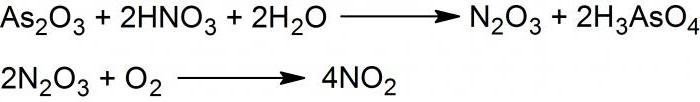
Диоксид, или NO2, получается при взаимодействии мышьяка трехвалентного оксида с 50 % кислотой азотной, которую наносят по каплям на поверхность твердого реагента. Образуется смесь из оксидов двухвалентного и четырехвалентного азота.
Если ее охладить до температуры -30 °С, то синтезируется ангидрид азотистый, или N2O3.
В порошкообразном виде он получается в случае пропускания тока электрического сквозь газообразную его форму.
Если на крахмальный порошок подействовать кислотой азотной с концентрацией 50 %, то выделяется оксид двухвалентного и четырехвалентного азота, газ углекислый и вода. В дальнейшем из полученных первых двух соединений формируется молекула N2O3.
В результате теплового расщепления свинцового нитросоединения выделяется диоксид азота, свободный кислород и оксид свинца.
Ангидрид, или N2O5, образуется благодаря отщеплению молекулы воды от кислоты азотной действием фосфора оксида пятивалентного.
Другой способ его синтеза является пропускание сухого хлора сквозь безводный серебряный нитрат.
Если на диоксид азотный подействовать молекулами озона, то формируется N2O5.
Естественное разложение NO x
Процессы образования и разрушения оксидов азота в атмосфере чрезвычайно сложны. Они состоят из множества реакций, на которые в той или иной степени влияют преобладающая температура, сила солнечного света, давление, загрязнение и соответствующие соотношения концентраций. Когда молекулы поднимаются в атмосферу, например, с одной стороны, вероятность реакции уменьшается из-за уменьшения давления, с другой стороны, некоторые столкновения с инертными молекулами устраняются, и интенсивность излучения увеличивается. Вот почему период полураспада веществ, участвующих в реакциях, меняется с высотой, а некоторые промежуточные продукты, которые очень недолговечны у земли, гораздо более стабильны в стратосфере. С другой стороны, такие соединения, как закись азота, которые относительно инертны на земле, могут медленно подниматься в стратосферу, где они в конечном итоге вступают в реакцию с другими соединениями. Типичная (но очень изменчивая) продолжительность жизни NO x составляет несколько часов для нижней тропосферы и несколько дней для верхней тропосферы. В стратосфере и мезосфере типичная продолжительность жизни составляет от нескольких дней до нескольких недель.
Азотистая кислота могла образоваться в атмосфере в результате вероятной гетерогенной реакции.
- НЕТ+НЕТ2+ЧАС2О⟶2ЛОР2{\ displaystyle {\ ce {NO + NO2 + H2O -> 2 HNO2}}}
Однако затем он подвергается фотолизу , поэтому во многих химических моделях он рассматривается как источник радикалов ОН.
- ЛОР2+hv⟶ОЙ+НЕТ{\ displaystyle {\ ce {HNO2 + hv -> OH + NO}}}
Пятиокись азота может встречаться в атмосфере как промежуточное соединение. Возникает з. Б. из диоксида азота и триоксида азота.
- НЕТ2+НЕТ3↽—⇀N2О5{\ displaystyle {\ ce {NO2 + NO3 <=> N2O5}}}
Как ангидрид азотной кислоты, он реагирует с водой (паром) с образованием азотной кислоты, хотя скорость реакции в газовой фазе точно не известна.
- N2О5+ЧАС2О⟶2ЛОР3{\ displaystyle {\ ce {N2O5 + H2O -> 2 HNO3}}}
Предполагается, что реакция протекает преимущественно неоднородно на влажных аэрозолях. Также большое значение имеет образование азотной кислоты в атмосфере по реакции:
- ОЙ+НЕТ2+М.⟶ЛОР3+М.{\ displaystyle {\ ce {OH + NO2 + M -> HNO3 + M}}}
При 25 ° C реакция протекает примерно в десять раз быстрее, чем рекомбинация радикалов ОН с диоксидом серы. Но азотная кислота также может быть навсегда удалена из реакционного цикла, например Б. накоплением на аэрозольных частицах или новым образованием (конденсацией) таких частиц. Газообразная азотная кислота химически очень стабильна в тропосфере вблизи земли и удаляется из атмосферы путем сухого и влажного осаждения из-за ее хорошей растворимости в воде.
Триоксид азота, в свою очередь, является важной частью ночной чистой и загрязненной тропосферы. В течение дня соединение подвергается фотолизу:
- НЕТ3+hv⟶НЕТ+О2{\ displaystyle {\ ce {NO3 + hv -> NO + O2}}}
- НЕТ3+hv⟶НЕТ2+О{\ displaystyle {\ ce {NO3 + hv -> NO2 + O}}}
Кроме того, триоксид азота быстро реагирует с монооксидом азота с образованием диоксида азота:
- НЕТ3+НЕТ⟶2НЕТ2{\ displaystyle {\ ce {NO3 + NO -> 2NO2}}}
Таким образом, срок службы триоксида азота в течение дня составляет менее 10 с. Факторами, влияющими на эти реакции, являются концентрация озона, интенсивность света (солнце), время пребывания соединений в атмосфере, загрязнение воздуха (например, пыль, диоксид серы) и образование смога.
Получение
Промышленный метод
В промышленных масштабах синтез оксида азота (II) является одной из стадий в получении азотной кислоты. Его получают окислением аммиака кислородом воздуха в присутствии катализаторов:
Количество преобразованного в NO аммиака составляет примерно 93-98%. Другими, побочными, реакциями является образование азота и оксида азота (I):
Кроме этого, может происходить частичное разложение конечного продукта, NO, а также его взаимодействие с аммиаком:
Согласно одной из самых распространенных теорий механизма окисления, предложенной Максом Боденштейном, аммиак окисляется атомарным кислородом, адсорбированным на катализаторе с образованием гидроксиламина, который постепенно разлагается с образованием NO:
Основными применяемыми катализаторами являются платина и, в меньшей степени, родий и палладий. Несмотря на их высокую стоимость, они имеют преимущество в высшем выходе реакции и меньшей склонности к отравлению.
Лабораторные методы
В лабораториях монооксид азота обычно добывают взаимодействием разбавленной азотной кислоты с медью при некотором нагревании по реакции:
Применяются также реакции восстановления нитритов в разведенной серной кислоте:
Полученный такими методами NO может быть загрязнен примесями (прежде всего, N 2 O), поэтому он требует дополнительной очистки.
Страницы
- Главная страница
- ОСНОВЫ ОБЩЕЙ ХИМИИ
- 1.1 Важнейшие классы неорганических веществ
- 2.1 Вещества. Атомы
- 2.2 Размеры атомов
- 2.3 Молекулы. Химические формулы
- 2.4 Простые и сложные вещества
- 2.5 Валентность элементов
- 2.6 Моль. Молярная масса
- 2.7 Закон Авогадро
- 2.8 Закон сохранения массы веществ
- 2.9 Вывод химических формул
- 3.1 Строение атома. Химическая связь
- 3.2 Строение атома
- 3.4 Строение электронной оболочки атома
- 3.5 Периодическая система химических элементов
- 3.6 Зависимость свойств элементов
- 3.7 Химическая связь и строение вещества
- 3.8 Гибридизация орбиталей
- 3.9 Донорно-акцепторный механизм образования
- 3.10 Степени окисления элементов
- 4.1 Классификация химических реакций
- 4.2 Тепловые эффекты реакций
- 4.3 Скорость химических реакций
- 4.4 Необратимые и обратимые реакции
- 4.5 Общая классификация химических реакций
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- 5.1 Растворы. Электролитическая диссоциация
- 5.2 Количественная характеристика состава растворов
- 5.3 Электролитическая диссоциация
- 5.4 Диссоциация кислот, оснований и солей
- 5.5 Диссоциация воды
- 5.6 Реакции обмена в водных растворах электролитов
- 5.7 Гидролиз солей
- 6.1 Важнейшие классы неорганических веществ
- 6.2 Кислоты, их свойства и получение
- 6.3 Амфотерные гидроксиды
- 6.4 Соли, их свойства и получение
- 6.5 Генетическая связь между важнейшими классами
- 6.6 Понятие о двойных солях
- 7.1 Металлы и их соединения
- 7.2 Электролиз
- 7.3 Общая характеристика металлов
- 7.4 Металлы главных подгрупп I и II групп
- 7.5 Алюминий
- 7.6 Железо
- 7.7 Хром
- 7.8 Важнейшие соединения марганца и меди
- 8.1 Неметаллы и их неорганические соединения
- 8.2 Водород, его получение
- 8.3 Галогены. Хлор
- 8.4 Халькогены. Кислород
- 8.5 Сера и ее важнейшие соединения
- 8.6 Азот. Аммиак. Соли аммония
- 8.7 Оксиды азота. Азотная кислота
- 8.8 Фосфор и его соединения
- 8.9 Углерод и его важнейшие соединения
- 8.10 Кремний и его важнейшие соединения
- ОРГАНИЧЕСКАЯ ХИМИЯ
- 9.1 Основные положения органической химии. Углеводороды
- 9.2 Электронные эффекты заместителей в органических соединениях
- 9.3 Предельные углеводороды (алканы)
- 9.3.1 Насыщенные УВ. Метан
- 9.4 Понятие о циклоалканах
- 9.5 Непредельные углеводороды
- 9.6 Диеновые углеводороды (алкадиены)
- 9.7 Алкины
- 9.8 Ароматические углеводороды
- 9.9 Природные источники углеводородов
- 10.1 Кислородсодержащие органические соединения
- 10.2 Фенолы
- 10.3 Альдегиды
- 10.4 Карбоновые кислоты
- 10.5 Сложные эфиры. Жиры
- 10.6 Понятие о поверхностно-активных веществах
- 10.7 Углеводы
- 11.1 Амины. Аминокислоты
- 11.2 Белки
- 11.3 Понятие о гетероциклических соединениях
- 11.4 Нуклеиновые кислоты
- 12.1 Высокомолекулярные соединения
- 12.2 Синтетические волокна
Предельно допустимая концентрация двуокиси азота
Все без исключения загрязняющие вещества должны соответствовать определенным нормам ПДК в воздухе. Соблюдение данных норм на производстве отслеживается специальными органами по регионам. В случае нарушения, в частности, при работе предприятий, на организации могут накладываться штрафы, а также более серьезные санкции, вплоть до закрытия.
NO2 относится ко второму классу опасности.
- Среднесуточной ПДК соединения является 0,4 мг/м3;
- Максимально разовым значением – 0,085 мг/м3.
При концентрации, присутствующей в атмосфере, двуокись азота считается потенциальным раздражителем, но даже в таком количестве она может негативно воздействовать на детский неокрепший организм. Так, дети возрастом 2-3 года могут заболевать бронхитом.
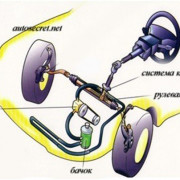
Что такое Закись Азота
Что такое? Оксид азота — бесцветный газ с характерным запахом, тяжелее воздуха (относительная плотность 1,527). Оксид азота применяется в медицине для наркоза. Химическая формула — N2О Содержание основного вещества( N2О) — не менее 97% Мощность производства — до 5,4 тыс. тонн в год Качество медицинской оксида азота соответствует требованиям Фармакопейной статьи ФС 42-2926-92. Свойства: При температуре 0 оС и давлении 40 ати закись азота сгущает-ся в бесцветную жидкость. Из 1 кг жидкой закиси азота образуется 500 л газа. Не воспламеняется, но поддерживает горение. Закись азота при вдыхании не вызывает раздражения дыхательных путей, с гемоглобином не связывается. После прекращения вдыхания через 10-15 минут полностью выделяется через дыхательные пути. Применяется в смеси с кислородом в качестве наркоза в хирурги-ческой практике, оперативной гинекологии, хирургической стоматологии, для обезболивания родов, для профилактики травматического шока в послеоперационный период, а также для купирования болевых приступов при острой коронарной недостаточности, инфаркте миокарда, остром панкреатите и других патало-гических состояниях, сопровождающихся болями. ТРЕБОВАНИЯ БЕЗОПАСНОСТИ Смеси с эфиром, циклопропаном , хлорэтилом в определенных концентрациях взрывоопасны. УПАКОВКА И ХРАНЕНИЕ Закись азота хранится в металлических баллонах вместимостью 10 л по 6,2 кг под давлением. Баллоны транспортируются в контейнерах и россыпью всеми видами транспорта в соответствии с правилами перевозки грузов, действующими на транспорте данного вида. ГАРАНТИЙНЫЙ СРОК ХРАНЕНИЯ — 5 ЛЕТ Зачем? Вы купили машину, которая, как вы думаете принадлежит к разряду быстрых. И внезапно замечаете, что есть машинки немного более резвые, чем ваша. Что делать? Продать старую и купить новую? Это решение для некоторых. Сделать тюнинг двигателя и ходовой? Это решение для других. Любой тюнинг — это соответствующее капиталовложение. Вы же потратили практически все деньги на покупку, регистрацию и прочую лабуду. И остались сзади. Что делать? Решение есть — поставить небольшую систему впрыска закиси азота. На обычную машину со стандартным компьютером. На автоматной HONDA RAFAGA с комплектом от ZEX на медицинском баллоне прибавка составила 1.7 сек на 400 метров. Соблюдая некоторые правила (включать не более 15 сек и затем охлаждать мотор), вы спокойно будете иметь запас по мощности 55-125 лошадиных сил. И в нужное время его применять. Если соберетесь продавать машину — проблем нет, система без следа демонтируется и легко ставится на другую. Как работает Закись азота под давлением в 1100 psi или 75 атм впрыскивается в камеры сгорания с помощью специальных форсунок. Вместе с закисью должно увеличится количество топлива впрыскиваемого в цилиндры. Это делается двумя способами. «Мокрый» способ — закись вместе с топливом впрыскивается в цилиндры через форсунки для закиси азота. Недостаток — необходимо контролировать давление в баллоне чтобы не обогатить смесью «Сухой» способ — закись впрыскивается через отдельную форсунку, а топливо через стандартные форсунки. Недостаток — ограниченная прибавочная мощность. Заправка Заправка — одна из самых главных проблем, с которой сталкиваются желающие поставить закись на свой автомобиль. Закись азота выпускается в России в баллонах по 6.5 кг вещества с давлением 45-50 атм. Это медицинские баллоны. Стоимость их низкая. Но есть проблемы с приобретением, так как до сих пор числится в разряде наркотиков. Первый и самый простой способ использовать эти баллоны. Для этого необходимо выточить бронзовую гайку под резьбу на русский баллон. В комплект ZEX входит контроллер, который позволяет ездить на том давлении, которое есть в баллоне, и иметь прибавку в мощности. В этом преимущество комплектов ZEX от конкурентов. При покупке обязательно надо проверять давление в баллонах, так как встречаются медицинские баллоны с очень низким давлением. Для этого очень хорошо иметь манометр в комплекте. Так же очень положительно влияет нагрев баллона до 30-35 градусов и расположение его в машине краном вниз. Второй способ — заправлять родной баллон, который идет в комплекте. Это можно делать с помощью соответствующего оборудования, например компрессора для заправки огнетушителей, и медицинских баллонов. Так же заправочную станцию можно приобрести от производителей систем впрыска закиси азота.