Оксид азота: формула, свойства, применение
Содержание:
- Характеристики
- Влияние оксидов азота
- Влияние на живые организмы
- Как получают оксиды азота
- Как работает закись азота
- Проведение анализа на наличие диоксида азота
- Фармакология
- Измерение уровня загрязнения воздуха в лаборатории «НОРТЕСТ»
- Оксид азота: свойства и все характеристики
- Формула ЕСЛИ в Excel – примеры нескольких условий
- Свойства [ править ]
- Физические свойства оксида азота (IV):
- Подготовка и реакции [ править ]
- Влияние на обоняние
- Применение углекислого газа
- Реакции
- Описание одновалентного оксида азота
Характеристики
Диоксид азота представляет собой красновато-коричневый газ при температуре выше 21,2 ° C (70,2 ° F; 294,3 K) с резким, едким запахом, становится желтовато-коричневой жидкостью при температуре ниже 21,2 ° C (70,2 ° F; 294,3 K) и превращается в бесцветный четырехокись азота ( N2О4) ниже -11,2 ° C (11,8 ° F, 261,9 K).
Длина связи между атомом азота и атомом кислорода составляет 119,7 пм . Эта длина связи соответствует порядку связи от одного до двух.
В отличие от озона , O 3 , основное электронное состояние диоксида азота представляет собой дублетное состояние , поскольку азот имеет один неспаренный электрон, что снижает альфа-эффект по сравнению с нитритом и создает слабое связывающее взаимодействие с неподеленными парами кислорода. Одинокий электрон в NO2также означает, что это соединение является свободным радикалом , поэтому формула диоксида азота часто записывается как • NO2.
Красновато-коричневый цвет является следствием преимущественного поглощения света в синей области спектра (400-500 нм), хотя поглощение распространяется во всем видимом (на более коротких длинах волн) и в инфракрасном диапазоне (на более длинных волнах). Поглощение света на длинах волн короче примерно 400 нм приводит к фотолизу (с образованием NO + O, атомарного кислорода); в атмосфере добавление образовавшегося таким образом атома O к O 2 приводит к образованию озона.
Влияние оксидов азота
→ Основная статья :
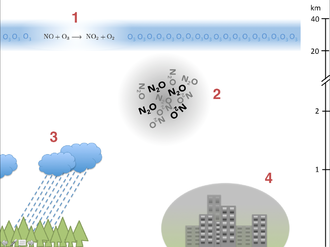
Оксиды азота действуют в разных местах атмосферы. Они вносят значительный вклад в разрушение озона в стратосфере (1), играют роль в глобальном потеплении в качестве газов, которые влияют на климат (2), вызывают кислотные дожди (3) и играют роль в образовании смога (4). ).
Оксиды азота, особенно диоксид азота, раздражают и повреждают органы дыхания. Повышенные концентрации в воздухе, которым вы дышите, отрицательно сказываются на функции легких у детей и взрослых. Они в значительной степени ответственны за образование кислотных дождей , при этом азотная кислота (HNO 3 ) вызывается реакцией (2 NO 2 + H 2 O → HNO 3 + HNO 2 ) или поглощением N 2 O 5 в аэрозоле. частиц и последующее образование NO 3 — возникает в жидкой фазе.
Окислы азота вблизи земли ответственны за образование озона (O 3 ) под воздействием ультрафиолетового излучения солнца в так называемом летнем смоге :
- (1) NО2+О2 →ЧАСν NО+О3{\ Displaystyle \ mathrm {(1) \ \ NO_ {2} + O_ {2} \ {\ xrightarrow {h \ nu}} \ NO + O_ {3}}}
Поскольку этот процесс обратим , количество озона наиболее высоко в солнечные дни днем и снова падает в течение ночи.
- (2) NО+О3 → NО2+О2{\ Displaystyle \ mathrm {(2) \ \ NO + O_ {3} \ {\ xrightarrow {\}} \ NO_ {2} + O_ {2}}}
Когда загрязняющие вещества переносятся от центров выбросов, NO все больше превращается в NO 2 , что ускоряет реакцию образования озона (1) и снижает реакцию разложения (2). Соответственно, более высокие уровни озона можно измерить в большей степени в сельской местности, чем в городах.
Для защиты здоровья человека предельное значение ЕС было установлено как среднегодовое значение концентрации диоксида азота (NO 2 ) в наружном воздухе на уровне 40 мкг / м 3 . Для определенных рабочих мест в промышленных секторах и торговле, где ожидается значительно более высокий уровень выбросов оксидов азота, применяется отдельное предельное значение для рабочих мест, которое допускает до 950 мкг / м 3 . Это значение применяется только к здоровым работникам и составляет максимум восемь часов в день и максимум 40 часов в неделю.
Веселящий газ (N 2 O) является парниковым газом и способствует глобальному потеплению . За 100-летний период его парниковый эффект в 298 раз больше, чем у CO 2 .
Оксиды азота от воздушных перевозок и, косвенно, закись азота также способствуют истощению озона в стратосфере. Веселящий газ фотолизируется УФ-излучением и образует NO, который, в свою очередь, расщепляет озон в соответствии с уравнением (2).
Влияние на живые организмы
В смеси с кислородом закись азота в малых концентрациях воздействует на нервную систему человека. Эффект напоминает опьянение лёгкой степени и сопровождается эйфорией. За это веществу дали название — «веселящий газ». В чистом виде вещество вызывает состояние опьянения и выраженную сонливость. При передозировке вначале вызывает приступ судорожного смеха, затем потерю сознания.
Монооксид азота — высокотоксичное соединение. Поступая в организм в больших концентрациях, способен изменить структуру гемоглобина, что взывает кислородное голодание. Оксид азота (IV) — крайне ядовитое вещество, представляющее опасность для здоровья и жизни.
Монооксид азота — вторичный посредник, который участвует в механизмах внутриклеточной и межклеточной передачи импульсов. Это вещество вырабатывают практически все живые организмы, от одноклеточных до млекопитающих.
Изначально окись азота была известна как эндотелиальный сосудорасширяющий фактор. Она образовалась в организме из аминокислоты аргинина. В химическом процессе участвуют молекулы кислорода, НАДФ и синтаза оксида азота. Другой способ образования вещества — восстановление неорганических солей азотной кислоты.
Эндотелиальные клетки сосудов передают сигнал гладкомышечным элементам, в результате сосуды расширяются и усиливается местный кровоток. Молекула оксида азота обладает способностью легко проникать через мембраны клеток. Благодаря этому она служит для обмена сигналами. Это благотворно влияет на состояние сердечно-сосудистой системы. Снижается риск ишемии миокарда и развития гипертонической болезни.
Уровень эндогенной окиси азота могут повышать растительные продукты — руккола, шпинат, свёкла, петрушка и прочие. Получение вещества из растительных продуктов требует присутствия сапрофитных микроорганизмов. В норме они живут в ротовой полости человека.
Как получают оксиды азота
Закись N2O образуется при острожном нагревании аммония нитрата в сухом виде, однако такой способ может сопровождаться взрывом.
Предпочтительным методом получения оксида одновалентного является воздействие кислотой азотной в концентрированном виде на кислоту сульфаминовую. Главным условием считается нагревание.
Нитрозил, или NO, – это особый оксид азота, получение которого осуществляется при взаимодействии молекул N2 иO2. Важным условием такого процесса является сильное нагревание свыше 1000 °C.
Природный способ получения связан с грозовыми разрядами в атмосферном воздухе. Такой оксид быстро соединяется с кислородными молекулами и формируется диоксид.
Лабораторный метод синтеза NO связан с реакцией металлов и неконцентрированной кислоты азотной. Примером такой реакции может быть взаимодействие меди с HNO3.
Другой способ образования моноокиси азота — реакция хлорида железа двухвалентного с натрия нитритом и кислотой соляной. Результатом процесса являются железа трехвалентного и натрия хлориды, вода и сама окись.
В промышленных масштабах его добывают за счет окисления аммиачных молекул во время нагревания и под высоким давлением. Ускорителем процесса является платина или хрома трехвалентного оксид.
Диоксид, или NO2, получается при взаимодействии мышьяка трехвалентного оксида с 50 % кислотой азотной, которую наносят по каплям на поверхность твердого реагента. Образуется смесь из оксидов двухвалентного и четырехвалентного азота.
Если ее охладить до температуры -30 °С, то синтезируется ангидрид азотистый, или N2O3.
В порошкообразном виде он получается в случае пропускания тока электрического сквозь газообразную его форму.
Если на крахмальный порошок подействовать кислотой азотной с концентрацией 50 %, то выделяется оксид двухвалентного и четырехвалентного азота, газ углекислый и вода. В дальнейшем из полученных первых двух соединений формируется молекула N2O3.
В результате теплового расщепления свинцового нитросоединения выделяется диоксид азота, свободный кислород и оксид свинца.
Ангидрид, или N2O5, образуется благодаря отщеплению молекулы воды от кислоты азотной действием фосфора оксида пятивалентного.
Другой способ его синтеза является пропускание сухого хлора сквозь безводный серебряный нитрат.
Если на диоксид азотный подействовать молекулами озона, то формируется N2O5.
Как работает закись азота
«Форсаж» познакомил большую часть населения с закисью азота. Как же она работает?
«Форсаж» – это один из самых дурацких автомобильных фильмов. За его сюжетом настолько легко следить, что даже не обязательно при этом знать английский язык. Но именно «Форсаж» познакомил большую часть населения с закисью азота. Возникает логичный вопрос: как же она работает?
Рецепт для любой реакции горения включает в себя топливо и кислород (его ваш двигатель получает из воздуха). Однако в воздухе кислорода не так и много (78% – это азот), то есть приличная часть всасываемой смеси теряется впустую. И вот тут на помощь приходит нитро!
В ДВС комбинация топлива и воздуха поджигается либо с помощью искры (в бензиновых моторах), либо с помощью сжатия (в дизельных моторах). Расширяющийся газ толкает поршень вниз (рабочий ход), передавая движение на коленвал, который в свою очередь через целый набор муфт, шестеренок, ремней и других валов направляет энергию на колеса.
Закись азота или N2O состоит из двух атомов азота и одного атома кислорода. При температуре около 300 градусов Цельсия химическая связь в молекуле разрушается, и кислород высвобождается. Таким образом в камере сгорания кислорода становится больше, что позволяет впрыскивать больше топлива, чтобы сохранить соотношение воздух/топливо оптимальным. Все это конвертируется в увеличенный крутящий момент и более быстрое ускорение.
В какой-то степени система во многом похожа на турбину, то есть ее задача загнать как можно больше кислорода в цилиндр. Только в отличие от турбины система закиси азота изменяет химический состав смеси.
Но если для сгорания необходим именно кислород, то зачем применять какой-то другой газ? Ну, закись азота предпочтительнее обычного сжатого кислорода, потому что она хорошо «упаковывается». Закись может быть легко сжижена, если находится под давлением, в то время как сжижение кислорода требует его замораживания до каких-то невероятных температур. N2O в плотном жидком состоянии занимает меньше места и содержит больше кислорода на единицу объема, чем сжатый газообразный O2. Плюс ко всему он безопаснее.
Автомобильная закись содержится в баллоне под давлением. Когда она подается в мотор, она представляет собой очень холодный газ, который охлаждает систему впуска, увеличивает плотность и дает еще больше кислорода. Количество этого газа контролируется жиклерами. От них зависит и уровень дополнительной мощности.
Система закиси азота полагается на существующий воздушный поток в двигатель. Поэтому нужно быть на полном газу, чтобы ее использовать. Если у вас механика, не вздумайте активировать нитро, когда убираете ногу с педали газа, чтобы переключить передачу, иначе может произойти обратный удар.
Система закиси азота – относительно недорогой способ быстрого добавления мощности. Комплект можно приобрести дешевле 1000 долларов. Наибольший смысл закись азота имеет, если вы участвуете в дрэг-рэйсинге.
Сам комплект имеет много составляющих и не работает по принципу «подключил и поехал». Он состоит из баллона, магистралей, соленоидов, жиклеров и проводки. Баллон обычно располагается в багажнике, а магистрали из нержавейки вплетаются в моторный отсек. Они соединены с соленоидами, которые функционируют как электрические клапаны, запуская или прерывая поток. Соленоиды спарены с жиклерами на впускном коллекторе, которые непосредственно впрыскивают закись азота в мотор.
Не думайте, что после монтажа системы все будет работать безупречно. Для начала нужно внести изменения в фазы зажигания. К счастью, некоторые комплекты поставляются с программным обеспечением, которое может это все отрегулировать.
Каждый мотор реагирует на дополнительную мощность по-разному. Прежде чем устанавливать систему закиси азота, нужно убедиться, что «железо» (двигатель, трансмиссия и система охлаждения) способно ее переварить.
Каждый, кто хоть раз смотрел известный во всем мире «Форсаж», наверняка заметил, что парни-гонщики и их красавицы-спутницы ездят на далеко не серийных автомобилях. Немудрено, что после выхода картины многие любители скорости и острых ощущений начали задумываться и от тюнинге своего авто. Для кото-то все закончилось наклейкой ярких стикеров, кто-то пошел чуть дальше и преобразил салон автомобиля, а самые отчаянные решили не ограничиваться полумерами и замахнулись на установку закиси азота. Еще бы… Ведь забыть, как «выстреливает» автомобиль после одного лишь нажатия кнопки, решительно невозможно. Но это в фильме. Будет ли такой сногсшибательный эффект в реальной жизни – вопрос пока открытый. Так что перед установкой закиси азота в любом случае не помешает разобраться с тем, что это такое и как оно работает.
Проведение анализа на наличие диоксида азота
Для выявления диоксида азота в воздухе, а также определения его концентрации может использоваться несколько методов. Их эффективность зависит от конкретной ситуации, а выбор осуществляется профильными специалистами. Среди самых распространенных методов можно назвать высокоэффективную газовую хроматографию и гравиметрию.
- Газовая хроматография представляет собой физико-химический метод, который реализуется посредством разделения компонентов тестируемой смеси между двумя фазами, движущимися относительно друг друга. В роли подвижной фазы используется сам газ, в то время как неподвижной может быть жидкость или сорбент, находящийся в твердом состоянии.
- Гравиметрия – это количественный анализ, который основан на определении массы выявляемого вещества. В связи с этим при реализации метода применяется закон сохранения массы. К преимуществам гравиметрии можно отнести низкий процент погрешности, не превышающий 0,2%, а также возможность отказа от предварительной градуировки измерительных приборов. Однако такой метод более трудоемкий и затратный по времени.
Фармакология
Добавочный оксид азота
NO, который синтезируется в организме и впоследствии высвобождается в кровь, имеет период полувыведения в 5 секунд или меньше, при этом в лабораторных условиях могут создаваться некоторые комплексы для увеличения периода полувыведения до 445 с или около того в целях исследования. Эти короткие периоды полувыведения свидетельствуют о быстром распаде молекулы оксида азота на составляющие (азот и кислород), при этом надлежащее хранение NO может увеличивать срок хранения, как было подтверждено, только до 5 дней, при использовании майларовых баллонов, которые замедляют разрушение. В связи с низкой устойчивостью вне организма, оксид азота по существу никогда не используется в качестве добавки, скорее используются соединения, которые могут сохраняться в крови на протяжении времени, достаточного для непрерывной выработки нового NO.
Оксид азота по существу неустойчив и имеет короткий период полувыведения; он оказывает полезное действие немедленно, но не имеет значения в качестве добавки и сам по себе. Добавка NO требует других соединений, которые оказывают влияние на внутреннюю систему выработки оксида азота.
Измерение уровня загрязнения воздуха в лаборатории «НОРТЕСТ»
С целью принятия оперативных мер по очистке воздуха от загрязнений, в том числе связанных с диоксидом азота, может потребоваться проведение соответствующих анализов. Испытательный центр «НОРТЕСТ» готов выполнить необходимые независимые исследования, гарантируя достоверные результаты и действуя в соответствии с установленными стандартами.
Наша лаборатория оснащена необходимым оборудованием для проведения анализов разной сложности. Также наши специалисты могут выехать на объект для забора проб и их безопасной доставки в центр. В случае определения повышенной концентрации диоксида азота, мы поможем в разработке решений, направленных на очистку воздуха от вредных примесей. Для этого может использоваться несколько способов, включая окисление, а также сорбционные методики.
Полезные статьи
Агрохимический анализ и исследования почв
Хлорорганические пестициды в воде
Методы определения бенз(а)пирена в почвах и грунтах
Оксид азота: свойства и все характеристики
В связи с тем, что в своих соединениях азот проявляет различные валентности, для этого элемента характерно несколько оксидов: оксид диазота, моно-, три-, ди- и пентаоксиды азота. Рассмотрим каждый из них более подробно.
Плохо растворяется в воде. При сильном охлаждении из раствора кристаллизуется кларат N2O×5,75H2O.
В твердом состоянии он полностью димеризован (N2O2), в жидком состоянии – частично (≈ 25% N2O2), в газе – в очень малой степени. Чрезвычайно термически устойчив. Плохо растворяется в воде.
При комнатной температуре на 90% разлагается на NOи NO2 и окрашивается в бурый цвет (NO2), не имеет температуры кипения (NO испаряется первым). В твердом состоянии – это белое или голубоватое вещество с ионным строением – нитрит нитрозила (NO+)(NO2—). В газе имеет молекулярное строение ON-NO2.
При температуре выше 135oС – это мономер, при комнатной температуре – красно-бурая смесь NO2 и его димера (тетраоксида диазота) N2O4. В жидком состоянии димер бесцветен, в твердом состоянии белый. Хорошо растворяется в холодной воде (насыщенный раствор – ярко-зеленый), полностью реагируя с ней.
При нагревании возгоняется и плавится, при комнатной температуре разлагается за 10 часов. В твердом состоянии имеет ионное строение (NO2+)(NO3—) – нитрат нитроила.
Таблица 1. Физические свойства оксидов азота.
| Молекулярная формула | N2O | NO | N2O3 | NO2 | N2O5 |
| Молярная масса, г/моль | 44 | 30 | 76 | 46 | 108 |
| Плотность, г/л | 1,9778 | 1,3402 | — | 2,0527 | — |
| Температура плавления, oС | -90,9 | -163,6 | -101 | -11,2 | 41 |
| Температура кипения, oС | -88,6 | -151,7 | 4,5 | 21,1 | — |
Получение оксида азота
В лабораторных условиях оксид диазота получают путем осторожного нагревания сухого нитрата аммония (1) или нагреванием смеси сульфаминовой и азотной (73%-ная) кислот (2):
NH4NO3 = N2O + 2H2O (1);
NH2SO2OH + HNO3 = N2O + H2SO4 + H2O (2).
Монооксид азота получают взаимодействием простых веществ азота и кислорода при высоких температурах (≈1300oС):
N2 + O2 = 2NO.
Кроме этого оксид азота (II) является одним из продуктов реакции растворения меди в разбавленной азотной кислоте:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O.
При охлаждении смеси газов, состоящей из оксидов азота (II) и (IV) до -36oС образуется триоксид азота:
NO + NO2 = N2O3.
Данное соединение можно получить при действии 50%-ной азотной кислоты на оксид мышьяка (III) (3) или крахмал (4):
2HNO3 + As2O3 = NO2 + NO + 2HAsO3 (3);
HNO3 + (C6H10O5)n = 6nNO + 6nNO2 + 6nCO2 + 11nH2O (4).
Термическое разложение нитрата свинца (II) приводит к образованию диоксидазота:
2Pb(NO3)2 = 2PbO + 4NO2 + O2.
Это же соединение образуется при растворении меди в концентрированной азотной кислоте:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O.
Пентаоксид азота получают путем пропускания сухого хлора над сухим нитратом серебра (5), а также по реакции взаимодействия между оксидом азота (IV) и озоном (6):
2Cl2 + 4AgNO3 = 2N2O5 + 4AgCl + O2 (5);
2NO2 + O3 = N2O5 + O2 (6).
Химические свойства оксида азота
Оксид диазота малореакционноспособный, не реагирует с разбавленными кислотами, щелочами, гидратом аммиака, кислородом. При нагревании реагирует с колнцентрированной серной кислотой, водородом, металлами, аммиаком. Поддерживает горение углерода и фосфора. В ОВР может проявлять свойства как слабого окислителя, так и слабого восстановителя.
Монооксид азота не реагирует с водой, разбавленными кислотами, щелочами, гидратом аммиака. Мгновенно присоединяет кислород. При нагревании реагирует с галогенами и другими неметаллами, сильными окислителями и восстановителями. Вступает в реакции комплексообразования.
Триоксид азота проявляет кислотные свойства, реагирует с водой, щелочами, гидратом аммиака. Энергично реагирует с кислородом и озоном, окисляет металлы.
Пентаоксид азота проявляет кислотные свойства, реагирует с водой, щелочами, гидратом аммиака. Является очень сильным окислителем.
Применение оксида азота
Оксид диазота используют в пищевой промышленности (пропеллент при изготовлении взбитых сливок), медицине (для ингаляционного наркоза), а также в качестве основного компонента ракетного топлива.
Триоксид и диоксид азота применяются в неорганическом синтезе для получения азотной и серной кислот. Оксид азота (IV) также нашел применение в качестве одного из компонентов ракетного топлива и смесевых взрывчатых веществ.
Формула ЕСЛИ в Excel – примеры нескольких условий
Довольно часто количество возможных условий не 2 (проверяемое и альтернативное), а 3, 4 и более. В этом случае также можно использовать функцию ЕСЛИ, но теперь ее придется вкладывать друг в друга, указывая все условия по очереди. Рассмотрим следующий пример.
Нескольким менеджерам по продажам нужно начислить премию в зависимости от выполнения плана продаж. Система мотивации следующая. Если план выполнен менее, чем на 90%, то премия не полагается, если от 90% до 95% — премия 10%, от 95% до 100% — премия 20% и если план перевыполнен, то 30%. Как видно здесь 4 варианта. Чтобы их указать в одной формуле потребуется следующая логическая структура. Если выполняется первое условие, то наступает первый вариант, в противном случае, если выполняется второе условие, то наступает второй вариант, в противном случае если… и т.д. Количество условий может быть довольно большим. В конце формулы указывается последний альтернативный вариант, для которого не выполняется ни одно из перечисленных ранее условий (как третье поле в обычной формуле ЕСЛИ). В итоге формула имеет следующий вид.
Комбинация функций ЕСЛИ работает так, что при выполнении какого-либо указанно условия следующие уже не проверяются
Поэтому важно их указать в правильной последовательности. Если бы мы начали проверку с B2
они входят в интервал B2
При написании формулы легко запутаться, поэтому рекомендуется смотреть на всплывающую подсказку.
В конце нужно обязательно закрыть все скобки, иначе эксель выдаст ошибку
Свойства [ править ]
Диоксид азота представляет собой красновато-коричневый газ при температуре выше 21,2 ° C (70,2 ° F; 294,3 K) с резким, едким запахом, становится желтовато-коричневой жидкостью при температуре ниже 21,2 ° C (70,2 ° F; 294,3 K) и превращается в бесцветный четырехокись азота ( N2О4) ниже -11,2 ° C (11,8 ° F, 261,9 K).
Длина связи между атомом азота и атомом кислорода составляет 119,7 пм . Эта длина связи соответствует порядку связи от одного до двух.
В отличие от озона , O 3 , основное электронное состояние диоксида азота является дублетным , поскольку у азота есть один неспаренный электрон , который снижает альфа-эффект по сравнению с нитритом и создает слабое связывающее взаимодействие с неподеленными парами кислорода. Одинокий электрон в NO2также означает, что это соединение является свободным радикалом , поэтому формула диоксида азота часто записывается как • NO2.
Красновато-коричневый цвет является следствием преимущественного поглощения света в синей области спектра (400-500 нм), хотя поглощение распространяется во всем видимом (на более коротких длинах волн) и в инфракрасном диапазоне (на более длинных волнах). Поглощение света на длинах волн короче примерно 400 нм приводит к фотолизу (с образованием NO + O, атомарного кислорода); в атмосфере добавление образовавшегося таким образом атома O к O 2 приводит к образованию озона.
Физические свойства оксида азота (IV):
| Наименование параметра: | Значение: |
| Химическая формула | NO2 |
| Синонимы и названия иностранном языке | nitrogen dioxide (англ.)
nitrogen(IV) oxide (англ.) азота двуокись (рус.) азота диоксид (рус.) диазота тетраоксид (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | красно-бурый газ или желтоватая жидкость |
| Цвет | красно-бурый, желтоватый |
| Вкус | —* |
| Запах | характерный острый запах |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | жидкость |
| Плотность (состояние вещества – жидкость, при 0 °C), кг/м
3 |
1491 |
| Плотность (состояние вещества – жидкость, при 0 °C), г/см
3 |
1,491 |
| Плотность (состояние вещества – газ), кг/м
3 |
2,0527 |
| Плотность (состояние вещества – газ), г/л | 2,0527 |
| Температура кипения, °C | 21,1 |
| Температура плавления, °C | -11,2 |
| Молярная масса, г/моль | 46,0055 |
Примечание:
* — нет данных.
Подготовка и реакции [ править ]
Диоксид азота обычно образуется в результате окисления оксида азота кислородом воздуха:
- 2 НО + О2→ 2 НЕТ2
Двуокись азота образуется в большинстве процессов сгорания с использованием воздуха в качестве окислителя . При повышенных температурах азот соединяется с кислородом с образованием оксида азота :
- О2+ N2→ 2 НЕТ
В лаборатории НЕТ2может быть получен с помощью двухэтапной процедуры, при которой при дегидратации азотной кислоты образуется пентоксид диазота , который впоследствии подвергается термическому разложению:
- 2 HNO3→ N2О5+ H2О
- 2 с.ш.2О5→ 4 НЕТ2+ O2
Термическое разложение нитратов некоторых металлов также дает NO2:
- 2 Pb (НЕТ3)2→ 2 PbO + 4 НО2+ O2
Как вариант, восстановление концентрированной азотной кислоты металлом (например, медью).
- 4 HNO3+ Cu → Cu (NO3)2+ 2 НЕТ2+ 2 часа2О
Или, наконец, путем добавления концентрированной азотной кислоты к олову в качестве побочного продукта получают гидратированный оксид олова .
- 4 HNO 3 + Sn → H 2 O + H 2 SnO 3 + 4 NO 2
Основные термические свойства
НЕТ2находится в равновесии с бесцветным газом четырехокиси азота ( N2О4):
- 2 НЕТ2⇌ N2О4
Равновесие характеризуется Δ H = -57,23 кДж / моль , что является экзотермическим. NO 2 предпочтительнее при более высоких температурах, тогда как при более низких температурах преобладает тетроксид диазота (N 2 O 4 ). Четырехокись азота ( N2О4) можно получить в виде белого твердого вещества с температурой плавления -11,2 ° C. NO 2 является парамагнитным из-за своего неспаренного электрона, а N 2 O 4 является диамагнитным .
Химия диоксида азота широко исследована. При 150 ° C, НЕТ2разлагается с выделением кислорода в результате эндотермического процесса ( Δ H = 14 кДж / моль ):
- 2 НЕТ2→ 2 НО + О2
Как окислитель
Судя по слабости связи N – O, NO2хороший окислитель. Следовательно, он будет гореть, иногда со взрывом, со многими соединениями, такими как углеводороды .
Гидролиз
Он гидролизуется с получением азотной кислоты и азотистой кислоты :
- 2 НЕТ2( N2О4) + H2O → HNO2+ HNO3
Эта реакция является одной из стадий процесса Оствальда промышленного производства азотной кислоты из аммиака. Эта реакция протекает пренебрежимо медленно при низких концентрациях NO 2, характерных для окружающей атмосферы, хотя она действительно продолжается при поглощении NO 2 на поверхности. Считается, что такая поверхностная реакция приводит к образованию газообразной HNO 2 (часто обозначаемой как HONO ) как внутри, так и снаружи помещений.
Образование при разложении азотной кислоты
Азотная кислота медленно разлагается до диоксида азота по общей реакции:
- 4 HNO3→ 4 НЕТ2+ 2 часа2О + О2
Образовавшийся таким образом диоксид азота придает характерный желтый цвет, который часто бывает у этой кислоты.
НЕТ2используется для получения безводных нитратов металлов из оксидов:
- Пн + 3 НЕТ2→ M (НЕТ3)2 + НЕТ
Преобразование в нитриты
Иодиды алкила и металлов дают соответствующие нитриты:
- 2 канала3I + 2 НЕТ2→ 2 канала3НЕТ2+ Я2
- TiI4+ 4 НЕТ2→ Ti (НЕТ2)4+ 2 я2
Влияние на обоняние
Даже если концентрация диоксида азота будет невысокой, люди способны ощущать его специфический запах. Пороговым значением фиксации газа в воздухе для человека считается 0,23 мг на куб. метр. Но при вдыхании диоксида азота в течение 10 минут теряется способность ощущать его запах, что говорит о негативном воздействии на обоняние, выражающемся в его ослаблении. При этом наблюдаются неприятная сухость в горле и раздражение слизистой, которые проходят при концентрации, превышающей пороговое значение обнаружения в 15 раз. Однако на смену приходят другие, более серьезные симптомы, означающие негативное воздействие двуокиси азота на органы дыхания.
Применение углекислого газа
В пищевой промышленности:
- используется при производстве минеральной воды и газированных напитков;
- как пищевая добавка (Е290), повышает сроки хранения продуктов;
- в качестве разрыхлителя придает легкость и пышность кондитерским изделиям;
- как хладогент;
- для удаления из кофе кофеина.
В авиамоделировании используется как источник энергии для двигателей; применяется в пневматическом оружии; как заправка для углекислотных огнетушителей. Используется в качестве защитной среды при сварке.
Находит углекислый газ применение и в медицине – используется для криоабляции новообразований, служит стимулятором глубокого дыхания.
В химической промышленности газ используется в синтезе химических веществ, производстве солей угольной кислоты, процессах осушки и очистки полимеров, волокон растительного и животного происхождения. Применяется для очистки сточных вод, повышает проводимость сверхчистой воды.
Реакции
С двух- и трехатомными молекулами
При конденсации в жидкость оксид азота димеризуется до диоксида азота , но эта ассоциация слабая и обратимая. Расстояние N – N в кристаллическом NO составляет 218 пм, что почти в два раза больше расстояния N – O.
Поскольку теплота образования · NO является эндотермической , NO может разлагаться на элементы. Каталитические нейтрализаторы в автомобилях используют эту реакцию:
- 2 НЕТ → O 2 + N 2 .
Под воздействием кислорода оксид азота превращается в диоксид азота :
- 2 НО + О 2 → 2 НО 2 .
Предполагается, что это преобразование происходит через промежуточное звено ONOONO.
В воде оксид азота реагирует с кислородом с образованием азотистой кислоты (HNO 2 ). Считается, что реакция протекает по следующей стехиометрии :
- 4 NO + O 2 + 2 H 2 O → 4 HNO 2 .
Оксид азота реагирует с фтором , хлором и бромом с образованием нитрозилгалогенидов, таких как нитрозилхлорид :
- 2 NO + Cl 2 → 2 NOCl.
С NO 2 , также являющимся радикалом, NO соединяется с образованием ярко-голубого триоксида азота :
- НЕТ + НЕТ 2 ⇌ ВКЛ-НЕТ 2 .
Органическая химия
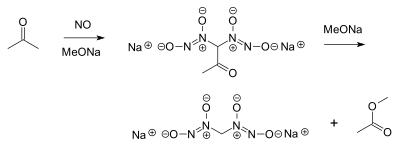
Присоединение фрагмента оксида азота к другой молекуле часто называют нитрозилированием . Реакция Трауба является дополнением из двух эквивалентов оксида азота на качестве енолята , давая diazeniumdiolate (также называемый nitrosohydroxylamine ). Продукт может подвергаться последующей ретроальдольной реакции , давая общий процесс, аналогичный галоформной реакции . Например, оксид азота реагирует с ацетоном и алкоксидом с образованием диазениядиолата в каждом α-положении с последующей потерей метилацетата в качестве побочного продукта :
Эта реакция, которая была открыта около 1898 года, по-прежнему представляет интерес для исследований пролекарств оксида азота . Оксид азота может также непосредственно реагировать с метоксидом натрия , в конечном итоге образуя формиат натрия и закись азота посредством N- метоксидиазениядиолата.
Координационные комплексы
Оксид азота реагирует с переходными металлами с образованием комплексов, называемых нитрозилами металлов . Наиболее распространенный способ связывания оксида азота — это терминальный линейный тип (M-NO). В качестве альтернативы оксид азота может служить одноэлектронным псевдогалогенидом. В таких комплексах группа M-N-O характеризуется углом от 120 ° до 140 °. Группа NO может также соединять металлические центры через атом азота в различных геометрических формах.
Описание одновалентного оксида азота
Он еще именуется диазотом, закисью и газом веселящим. Последнее название произошло от действия, связанного с опьянением.
Оксид азота с валентностью I в условиях нормальной температуры существует в форме негорючего газа, без цвета, который проявляет приятный сладковатый привкус и запах. Воздух легче данного соединения. Оксид растворяется в водной среде, этаноле, эфирах и кислоте серной.
Вода, щелочные и кислотные растворы не способны с ним вступать в реакцию, он не образует соли. Не подвергается воспламенению, зато способен поддержать процесс горения.
Аммиак оксид азота переводит в азид (N3NH4).
При соединении с молекулами эфиров, хлорэтана и циклопропана образуется взрывоопасная смесь.
Обычные условия способствуют его инертности. Под действием нагревания вещество восстанавливается.